- Задайте ваш вопрос

- +7 (931) 521-29-11 Бесплатно по РФ

Из этой статьи вы узнаете:
Молекулярная структура воды уникальна. Удивительным образом здесь сочетается несочетаемое: подвижность жидкого вещества и прочный кристаллический материал, который мы называем льдом. Разумеется, молекулы меняются в различных агрегатных состояниях: газообразном, твердом и жидком.
Сегодня подробно расскажем про строение молекул воды, которая оказывает столь важное влияние на все живое на планете и на само качество нашей жизни.
Длительный период времени ученые описывали молекулярную структуру воды простым соединением без возможности комплексных взаимодействий с другими веществами. И наконец, вода была поставлена в один ряд со сложными веществами химиком Лавуазье в 1783 г.
Молекулярный состав воды определяется тремя атомами; из них два атома водорода и один атом кислорода, имеющие между собой ковалентную связь.
Химическая формула воды: H₂O.
Основные характеристики ковалентной связи выражены такими понятиями, как направленность, насыщаемость, полярность, поляризуемость. Эти параметры являются химическими и физическими свойствами соединений.
Форма молекулы воды похожа на равнобедренный треугольник с двумя атомами водорода в основании (по одному атому в каждом углу). Между атомами кислорода и водорода наблюдается полярная связь, которая объясняется свойством кислорода сильнее (по сравнению с водородом) притягивать электроны.
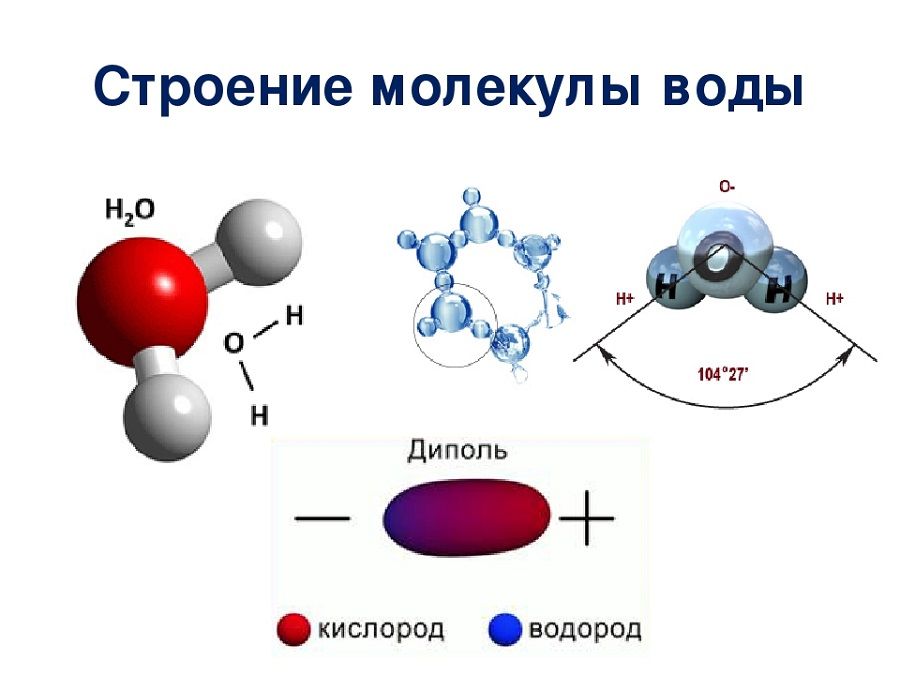
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекулярная структура воды подразумевает наличие двух положительно и двух отрицательно заряженных полюса, этим можно объяснить ее проявление в качестве диполя (в большинстве случаев).
Показатели эффективных зарядов на атомах равны ±0,17 от заряда электрона.
Наличие водородной связи наделяет воду в жидком состоянии свойством осуществлять ассоциацию молекул (соединять их в сложные вещества).
Особое внимание водородная связь заслужила благодаря своей не сильно высокой устойчивости.
Кроме того, водородная связь оказывает прямое влияние на способность воды растворять вещества, так как конкретно от соединения водородных связей с растворителем зависят характеристики растворимости. Именно взаимодействием водородных связей с содержащими ОН-группы веществами (сахар, глюкоза, спирт, карбоновые кислоты) можно объяснить их отличный уровень растворения в воде.
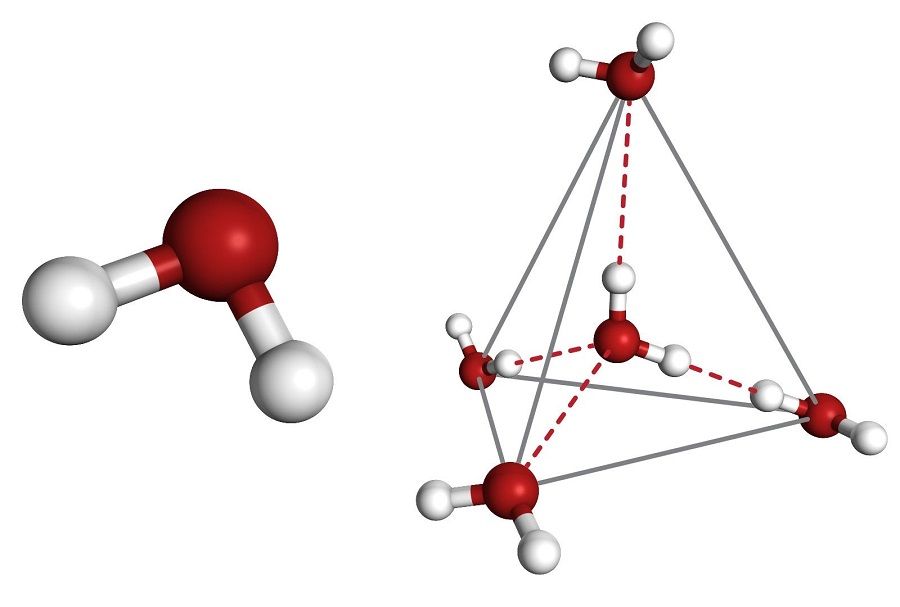
Димер — это водородная связь двух молекул H2O.
Каждая молекула имеет способность формировать четыре водородные связи: две между неподеленными парами ее атома кислорода и атомами водорода соседних молекул и еще две – между атомами водорода и атомами кислорода двух соседних молекул.
Границы энергии водородной связи могут варьироваться от 17 до 33 кДж/моль.
Различают несколько состояний воды:
Жидкое. Основное состояние в нормальных условиях.
Твердое. Это лед, а также в форме кристаллов – иней или снег.
Газообразное — водяной пар.
Выделяют также и переходные состояния воды, которые обусловлены ее замерзанием или испарением.
Удивительно и в то же время вполне естественно, что можно наблюдать соседство и даже взаимодействие воды, одновременно находящейся в разных агрегатных состояниях: озера с ледниками, айсберги в океане, облака на небе, состоящие из водяного пара и капель жидкой воды.
Ознакомимся подробнее с особенностями каждого агрегатного состояния воды.
Вода в ее естественном жидком состоянии содержит одиночные (моногидроли), двойные (дигидроли) и тройные (тригидроли) молекулы. Их соотношение и количество определяется температурой и влияет на то, в каком из трех состояний вода находится в текущий момент.
Пар включает одну H₂O-гидроль (моногидроль). Пар образуется при нагревании, которое способствует активному движению молекул, что, в свою очередь, нарушает связь между ними. Моногидроли в газообразном состоянии не соединены между собой.
#TEN_PRODUCTS#
Две молекулы H₂O обозначают жидкое состояние – дигидроль. В данном случае молекулы соединены, но между ними есть пустоты.
Три молекулы H₂O включает лед. Его твердость можно объяснить очень плотной связью между тригидролями.
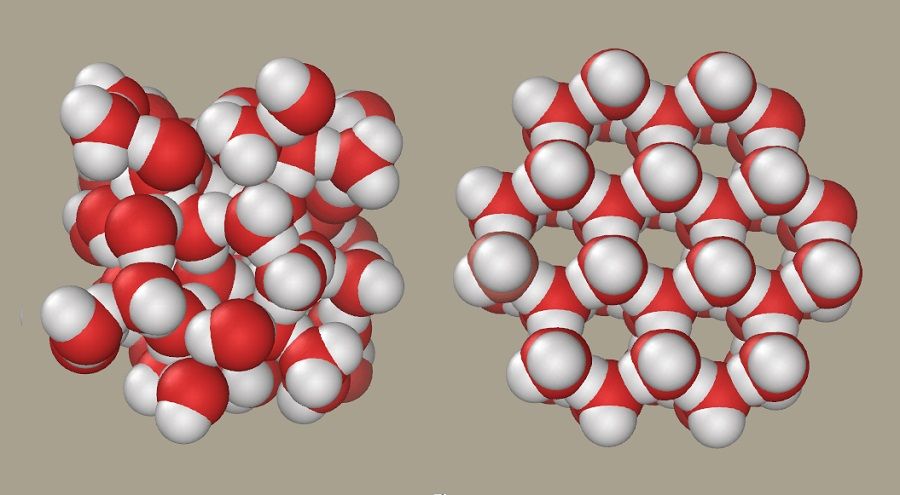
Также существуют еще и переходные состояния жидкости, такие как испарение или замерзание. Попробуем понять, есть ли отличия между льдом и водой на уровне молекулярного строения. При замерзании вода приобретает структуру кристалла, например, в форме тетраэдра, тригональной и моноклинной сингонии, куба.
Различия в молекулярной структуре воды и льда есть в первую очередь в плотности: кристаллы по своему строению объемные, но менее плотные. Но главное, что отличает их друг от друга, – это водородные связи, которые выражаются разными видами, количеством и силой.
Как правило, молекулы воды не имеют сильного притяжения и определенного порядка расположения, благодаря чему, собственно, жидкость обладает свойством текучести. Структура льда своей формой кристаллической решетки говорит о значительной силе притяжения между молекулами.
Состав не меняется ни в одном агрегатном состоянии. К отличиям также можно отнести разное поведение молекул воды и льда во время движения и их строение.
Популярным остается вопрос, отличаются ли по объему и составу молекул холодная и горячая вода. Как уже говорилось выше, состав воды всегда один и тот же. Конкретно в горячем и холодном состоянии молекулы жидкости отличаются расположением. Объем также разный, это объясняется тем, что молекулярная структура холодной воды упорядочена, а горячей – хаотична.
При таянии температура льда постоянна. Только когда агрегатное состояние полностью сменится, стрелка термометра начнет подниматься вверх. Во время таяния льда выделяется энергия, равная 25 000 Дж/кг, ее называют удельной теплотой плавления (лямбда воды).
Твердая – это замерзшая вода. При замерзании расстояние между ее молекулами увеличивается, за счет чего уже в состоянии льда ее плотность уменьшается, однако объем при этом становится больше.
Молекулярная структура воды наделяет ее специфической особенностью – расширяться при низких температурах, в то время как большинство веществ, наоборот, сжимаются.
Понятие «вода замерзает» означает, что она из жидкого вещества путем кристаллизации превращается в твердое, при этом температура окружающей среды равна 0 градусов и ниже. Цифра, при которой вода начнет замерзать, может быть и меньше, если в жидкости есть соли.
Интересно! Все мы привыкли, что основное состояние воды жидкое. Однако большая часть запасов воды на планете Земля хранится в состоянии льда. Ледники занимают 11 % всей сухой поверхности земного шара.
Если чистая вода (без примесей солей) замерзает при 0 градусов Цельсия, то морская ее «родственница» превращается в лед примерно при -1,8 градусах Цельсия.
Вода в жидком состоянии на Земле находится не только в реках и океанах. Осадки в виде дождя, маленькие капельки, спрятанные в облаках, – это все тоже жидкость.
#NEW_ARTICLE_IN#Также встретить воду в жидком состоянии можно под землей, куда она уходит через почву, образуя подземные скопления, из которых состоит основной объем запасов питьевой воды.
В жидком виде вода обладает свойством прилипания к твердым веществам, легко увлажняя их поверхность.
Из жидкого состояния она без труда, при определенных показателях температуры и давления, превращается в газ (пар) или лед.
Физическое превращение воды из жидкости в газ называют испарением, ввиду того что газообразное состояние воды называется паром.
Пар — это вода в газообразном состоянии, которое наблюдается в процессе кипения или испарения. Физический пар увидеть невозможно, при этом понятие «пар» мы привыкли ассоциировать с влажным паром, который проявляется в виде тумана, разбрызгивания водяных капелек, формирующихся при конденсации водяного пара.
Здесь вспомним про понятие «точка росы», которая фактически обозначает показатель температуры, изменяющийся под влиянием давления и влажности. При значениях ниже точки росы начинается процесс конденсации водного пара: переход воды из одного агрегатного состояния (в данном случае газообразного) в другое – жидкое. Другими словами, происходит образование росы.
Закипает жидкая пресная вода при 100 °C (градусах Цельсия), или 212 °F (градусах Фаренгейта), в условиях нормального атмосферного давления. При снижении давления (в горах, например) значение температуры кипения увеличивается.
[[rlink.1192]]Рассмотрим, какие существуют процессы перехода воды из одного агрегатного состояния в другое:
кипение и парообразование — превращение воды в пар;
конденсация — обратный процесс, пар становится водой;
кристаллизация — вода превращается в лед;
плавление – наоборот, лед становится водой;
сублимация – процесс преобразования льда в пар;
десублимация – превращение пара в лед (иней).
Показатели перехода воды в разные агрегатные состояния лед/вода и вода/пар условились определять соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст., или 101 325 Па.
В естественном состоянии вода представляет собой бесцветную, безвкусную, ничем не пахнущую жидкость.
Она обладает способностью растворять огромное количество веществ. В природных условиях вода содержит растворенные в ней газы и соли.
Вода в чистом виде считается неплохим изолятором, при условии, что концентрация протонов и гидроксильных ионов в ней равна 10–7 моль/л. Но в таком виде ее можно встретить редко: в жидкости практически всегда присутствуют растворенные вещества с положительными и отрицательным ионами, которые, в свою очередь, наделяют ее свойствами проводить ток. Именно на основании степени электропроводности можно судить о чистоте воды.
Даже активное воздействие других веществ на воду не способно изменить ее состав, что является важным свойством для всего живого на планете. Так как полезные вещества, попадающие в организм с помощью жидкости, передаются в неизменном виде.
Также вода отлично справляется с функцией поглощения инфракрасных и микроволновых лучей. По мере прохождения всех этапов гидрологического цикла (круговорота воды в природе – испарение, конденсация и выпадение осадков) вода может насыщаться различными химическими элементами, среди которых выделяют 6 категорий.
#ARTICLE_VIONE_TS#Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
|
Ионы |
Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем по сравнению с другими количестве. |
|
Растворенные газы |
Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
|
Биогенные элементы |
Главными из них являются фосфор и азот, которые поступают в жидкость из осадков. |
|
Микроэлементы |
Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Концентрации их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
|
Органические вещества |
Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
|
Токсины |
Тяжелые металлы и продукты нефтепереработки. |
В современном мире для очистки воды от вредных веществ используют эффективные надежные способы.
В зависимости от концентрации магния или катионов кальция вода бывает мягкой и жесткой соответственно.
[[rlink.1182]]По молекулярной структуре воды и изотопному составу ее определяют как легкую, тяжелую и сверхтяжелую. Данная характеристика в основном зависит от количества изотопов водорода в молекуле воды.
[sales_slider]Вода незаменима и жизненно необходима в любом виде для всех живых существ. Она поддерживает беспрерывный процесс круговорота воды в природе, не давая высохнуть морям, которые пополняются за счет осадков и подводных вод. Осадки, в свою очередь, образуются в процессе испарения влаги с поверхности почвы и водоемов. Несмотря на постоянные изменения состояния воды, ее количество на планете остается стабильным.